QMKontakt.de liefert Ihnen die Vorlage für Ihr QM-System, zur Akkreditierung oder Zulassung.
QM-Handbücher für Zertifizierungen, Akkreditier... QMHandbuch zur ISO 13485:2021 Medizinprodukte P...
QMHandbuch zur ISO 13485:2021 Medizinprodukte Produktion, Dienstleistung ohne MDR

Ein QM-System nach dieser Norm ist nicht einfach zu erstellen. Wir haben eine umfassende Vorlage, die nur noch ausgefüllt und angepasst werden muss. Nicht betrachtet ist die Entwicklung als Inverkehrbringer nach MDR 2017/745.
Beschreibung:
Wir haben die Formblätter und Nachweisformen mit Beispielen gefüllt. Dies vereinfacht die Erstellung und Anpassung. Die Disziplinen Produktion, Vertrieb und Dienstleistung sind beachtet (keine Entwicklung). Die Struktur des Regelwerkes richtet sich nach der Norm: Das bedeutet, dass alle Dokumente nach dem entsprechenden Normpunkt nummeriert sind. Der Aufwand zur Anpassung des Regelwerkes unter Beachtung von MS-Office Kenntnissen ist gering. Für Unternehmen mit bestehender Zertifizierung, dient das Regelwerk dazu den neuen Normforderungen gerecht zu werden. Die Nummerierung entspricht der zugrundeliegenden Norm DIN EN ISO 13485:2021 . So kann eine Zuordnung zur Norm leicht realisiert werden.
Um auch eine Zertifizierung nach ISO 9001 zu realisieren, haben wir ein ergänzendes Verzeichnis eingefügt.
Zielgruppe:
- Produzenten von Medizinprodukten oder Teilen davon ohne eigene Inverkehrbringung eines Medizinproduktes
- Veredler von Medizinprodukten wie Beschichtung...
- Dienstleister für Medizinproduktehersteller wie Schulung, Installation, Wartung und vieles mehr.
Gliederung Verzeichnisse:
- Handbuch (8 Kapitel),
- Prozessbeschreibungen (60 Beispiele),
- Anweisungsbeispiele (8 Beispiele),
- Formblätter / Nachweisvorlagen (55 Beispiele),
- ISO 13485 Zusatz zur ISO 9001.
Downloadpreis: 136,00 € inkl. gesetzlicher MwSt
ISBN bei Bestellung über den Buchhandel 978-3-942882-14-1.
Lieferung:
- per Download,
Konditionen:
- Keine Ergänzungslieferungen,
- Rückgaberecht,
- Bezahlung per PayPal oder Rechnung,
- Alle Dateien in MS-Office wie MS-Word, MS-Excel und PowerPoint und
- Keine Lizenzgebühren
Inhalte QM-Hhandbuch
Strukturiert nach den 8 Kapiteln der Norm DIN EN ISO 13485:2021.
- Kapitel 1 und 2 Anwendungsbereich & Normative Verweise
- Kapitel 3 Begriffe Abkürzungen
- Kapitel 4 Qualitätsmanagementsystem
- Kapitel 5 Verantwortung der Leitung
- Kapitel 6 Management von Ressourcen
- Kapitel 7 Produktions- und Dienstleistungserbringung
- Kapitel 8 Messung, Analyse & Verbesserung
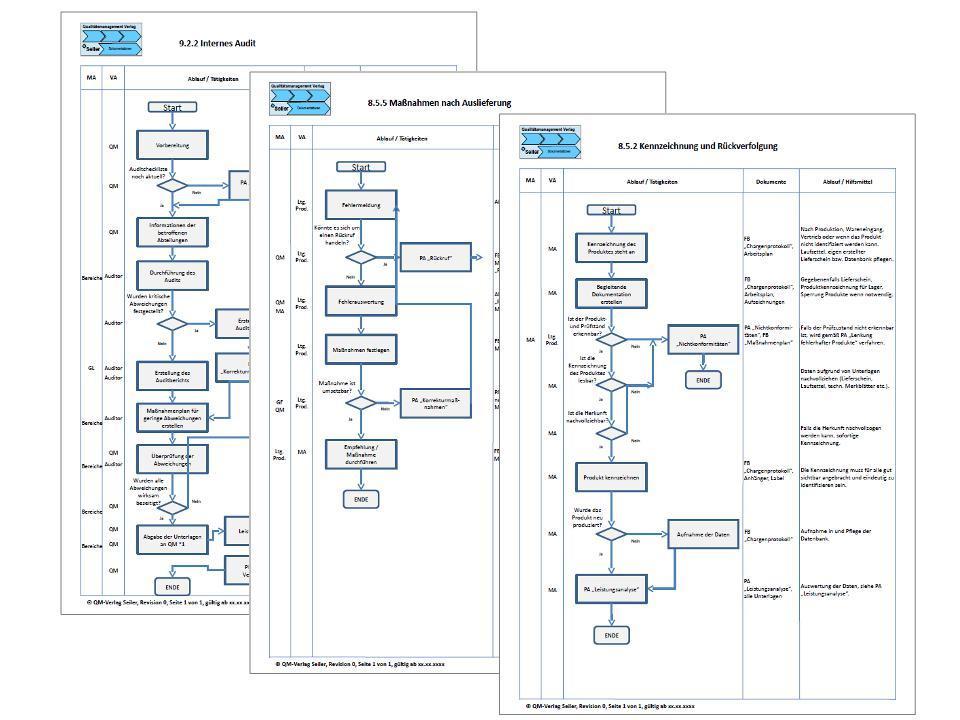
Prozessbeschreibungen
- 4.1.6 Validierung Software
- 4.2.4 Lenkung externer Dokumente
- 4.2.4 Lenkung von Dokumenten
- 4.2.5 Lenkung von Qualitätsaufzeichnungen
- 4.2.5 Vertrauliche Informationen
- 5.3.0 Qualitätspolitik
- 5.4.1 Qualitätsziele
- 5.5.3 Interne Kommunikation
- 5.6.0 Managementbewertung
- 6.1.0 Planung Produktionsmittel
- 6.2.0 Einführung neuer Mitarbeiter
- 6.2.0 Einstellung
- 6.2.0 Erforderliche Ausbildung
- 6.2.0 Schulungen
- 6.2.0 Weiterbildung
- 6.3.0 Externe Wartungen
- 6.3.0 Interne Wartungen
- 7.1.0 Arbeitsvorbereitung
- 7.1.0 Risikomanagement Produktion
- 7.2.3 Angebotserstellung
- 7.2.3 Auftragsabwicklung
- 7.2.3 Auftragsänderung
- 7.2.3 Vertrieb
- 7.4.1 Auswahl Lieferanten
- 7.4.1 Beschaffung
- 7.4.1 Lieferantenaudit
- 7.4.1 Lieferantenbewertung
- 7.4.1 Lieferantenkommunikation
- 7.4.1 Rahmenverträge
- 7.4.3 Wareneingang
- 7.5.1 Dienstleistung
- 7.5.1 Produktion
- 7.5.3 / 7.5.4 Installation Instandhaltung
- 7.5.6 Prozessvalidierung
- 7.5.8 Anlieferung
- 7.5.8 Identifizierung
- 7.5.8 Rücklieferungen
- 7.5.9 Rückverfolgbarkeit
- 7.5.10 Eigentum des Kunden
- 7.5.11 Einlagern
- 7.5.11 Verpackung
- 7.5.11 Versand
- 7.6.0 Überwachung Messmittel
- 8.2.1 Kundenzufriedenheit
- 8.2.1 Rückmeldungen
- 8.2.2 Reklamationsbearbeitung
- 8.2.4 Internes Audit
- 8.2.6 Besondere Prüfungen
- 8.2.6 Externe Prüfungen / Labor
- 8.2.6 Planung Prüfungen
- 8.2.6 Serienprüfungen
- 8.2.6 Verifizierung Produktion
- 8.3.1 Lenkung nichtkonformer Produkte
- 8.3.1 Rückruf
- 8.3.3 Empfehlungen und Maßnahmen nach Auslieferung
- 8.3.4 Nacharbeit
- 8.4.0 Datenanalyse
- 8.5.1 Planung Verbesserung
- 8.5.2 Korrekturmaßnahmen
- 8.5.3 Vorbeugemaßnahmen
Arbeitsanweisungen
- 4.2.4 Erstellen von Dokumenten
- 6.4.2 Verunreinigte Produkte
- 7.2.3 Angebotserstellung
- 7.4.1 Auswahl Lieferanten
- 7.4.1 Regeln der Beschaffung
- 7.4.3 Wareneingang
- 7.5.9 Rückverfolgbarkeit
- 7.5.11 Produkterhaltung
- 7.6.0 Umgang mit Prüfmitteln
Formblätter / Nachweisformen
- 4.0.0 Dokumentationsebenen (eingebunden in Kapitel 4)
- 4.1.5 QSV kritische Prozesse
- 4.1.6 Softwarevalidierung
- 4.2.2 Wechselwirkungen der Prozesse
- 4.2.4 Liste der Dokumente (diese Datei)
- 4.2.5 Auflistung der Aufzeichnungen
- 5.1.0 / 5.3.0 Verpflichtung der Leitung / Qualitätspolitik
- 5 1 0 Erklärung kein anderer Zertifizierer
- 5.4.1 Qualitätsziele
- 5.5.1 Organisationsdiagramm
- 5.5.1 Verantwortungen und Befugnisse
- 5.5.2 Benennungsschreiben BDL
- 5 5 3 Liste Kommunikationswege
- 5.6.0 Managementbewertung
- 6.2.0 Ausbildungs- und Befugnismatrix
- 6.2.0 Stellenbeschreibung
- 6.2.0 Unterweisungsnachweis
- 6.2.0 Schweigepflicht
- 6.3.0 Infrastruktur
- 6.3.0 Liste der Maschinen
- 6.3.0 Maßnahmen Wartung
- 6.3.0 Wartungsnachweis
- 6.4.0 Abfallplan
- 6.4.0 Präventionskonzept
- 6.4.0 Sauberkeitskonzept
- 7.1.0 Prozesskette / Qualitätsplan
- 7.1.0 Risiken Maßnahmen
- 7.4.1 Ausgegliederte Prozesse
- 7.4.1 Checkliste Lieferanten
- 7.4.1 Lieferantenbewertung
- 7.5.1 Chargenprotokoll
- 7.5.4 Tätigkeiten Installation
- 7.5.4 Instandhaltung Produkt
- 7.5.6 Prozessänderungen
- 7.5.6 Prozessvalidierung
- 7.5.8 Begleitblatt Produktstatus
- 7.6.0 Prüfgerätekartei
- 8.2.1 Kundenzufriedenheit Reklamationen
- 8.2.1 Rückmeldungen
- 8.2.4 Auditabweichung
- 8.2.4 Auditbericht
- 8.2.4 Auditcheckliste 13485:2021
- 8.2.4 Auditcheckliste Lieferanten
- 8.2.4 Auditplan
- 8.2.4 Auditprogramm
- 8.2.6 Prüfplan
- 8.3.1 Fehlerliste
- 8.3.1 Lenkung nichtkonformer Produkte
- 8.3.2 Sonderfreigaben
- 8.3.3 Maßnahmenempfehlungen
- 8.3.4 Nacharbeit / Nachbesserungen
- 8.4.0 Datenanalyse
- 8.5.1 Verbesserungen
- 8.5.2 / 8.5.3 Korrektur- und Vorbeugemaßnahmen
- 8.5.2 Korrekturmaßnahmen
ISO 13485 Zusatz zur ISO 9001
- FB 4 4 0 Kontext
- FB 4 1 0 Kontext Erfordernisse und Erwartungen
- FB 6 1 0 Chancen und Risiken
- FB 9 1 2 Kundenzufriedenheit
- PA 6 1 0 Ermittlung Risiken Chancen
- Zusatz Regelwerk 9001
Informieren Sie sich unverbindlich über unsere zusätzlichen Beratungsmodule.
Gerne lassen wir Ihnen hierzu weitere Informationen zukommen.
Wählen Sie Hierzu bitte das entsprechende Beratungsmodul.